Tietoa QdengaTM-valmisteesta
Auta matkailijoita suojautumaan denguekuumeelta QdengaTM -rokotteella 1-4
QdengaTM-valmistetta tukee vahva kliinisen tuotekehityksen ohjelma, joka kattaa 19 vaiheiden I, II ja III kliinistä tutkimusta ja niissä kaikkiaan 28 175 koehenkilöä ja 88 tutkimuskeskusta yhteensä 13 maassa. 5-22

QdengaTM on tarkoitettu minkä tahansa dengueviruksen serotyypin aiheuttaman denguetaudin ehkäisyyn vähintään 4-vuotiaille 1
Tutkimusasetelma
TIDES: Tutkimusasetelma
TIDES: Kolmivalenttinen immunisaatio dengueta vastaan, tehokkuustutkimus terveissä lapsissa 2,3
- TIDES on keskeinen, käynnissä oleva, monikansallinen, kaksoissokkoutettu, satunnaistettu, lumekontrolloitu vaiheen III tutkimus, jossa arvioidaan Qdenga™-valmisteen tehoa, turvallisuutta ja immunogeenisuutta denguekuumetta vastaan. 1-3
- Kaikkiaan 20 099 iältään 4–16-vuotiaalle terveelle henkilölle kahdeksasta denguekuumeen endeemisestä maasta annettiin vähintään yksi rokoteannos tai lumelääkettä 2,3
- Brasilia, Kolumbia, Dominikaaninen tasavalta, Nicaragua, Panama, Filippiinit, Sri Lanka ja Thaimaa
- Koehenkilöitä otettiin mukaan Aasiasta ja Tyynenmeren alueelta (46,5 %) sekä Latinalaisesta Amerikasta (53.5 %)
- TIDES-tutkimuksessa 91 % koehenkilöistä pysyi mukana ja osallistui viikottaiseen seurantaan koko sen 4,5 vuoden keston ajan.1,4
- TIDES-tutkimuksessa oli mukana sekä henkilöitä, jotka eivät olleet sairastaneet denguekuumetta että niitä, jotka olivat aiemmin altistuneet virukselle.2,3
- Lähtötilanteessa 27,7 % henkilöistä oli seronegatiivisia kaikkien neljän dengueviruksen serotyypin suhteen.
- Poissulkukriteerejä olivat kuumetauti lähtötilanteessa, heikentynyt/muuttunut immuunipuolustus, yliherkkyys mille tahansa rokotteen aineosalle, raskaus/imetys, aiemmin saatu denguekuumerokote sekä muut tutkimuksen kriteerien mukaiset tutkimussuunnitelman rikkomukset. 2,3
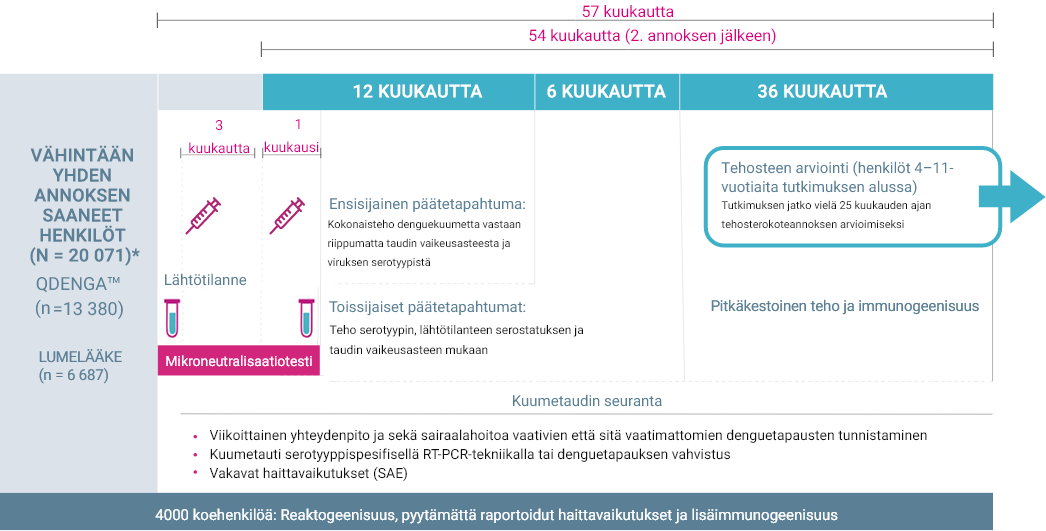

* Yksi 0,5 ml:n Qdenga™-annos sisälsi noin 3,6 (kanta DENV-1), 4,0 (kanta DENV-2), 4,6 (kanta DENV-3) ja 5,1 (kanta DENV-4) log10 plakin muodostavaa yksikköä, ja lumelääke oli 0,5 ml keittosuolaliuosta. Neljä henkilöä sai sekä rokotteen että lumelääkettä hallinnollisten virheiden takia; nämä henkilöt eivät ole mukana kokonaismäärissä.2
Muokattu lähteestä: Biswal ym. 2019; Biswal ym. (2020) 2,3
Teho
TIDES: Tehotiedot
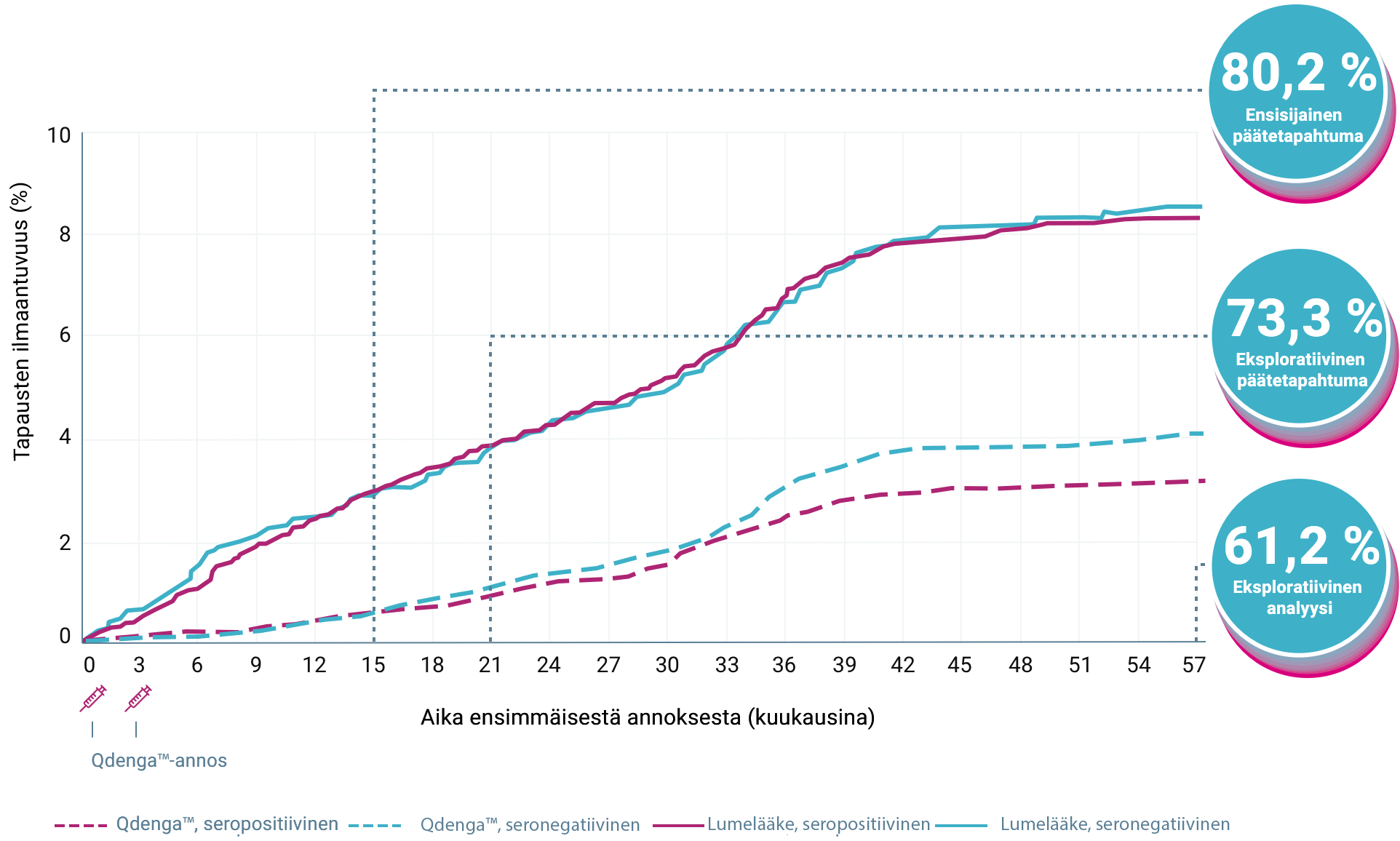
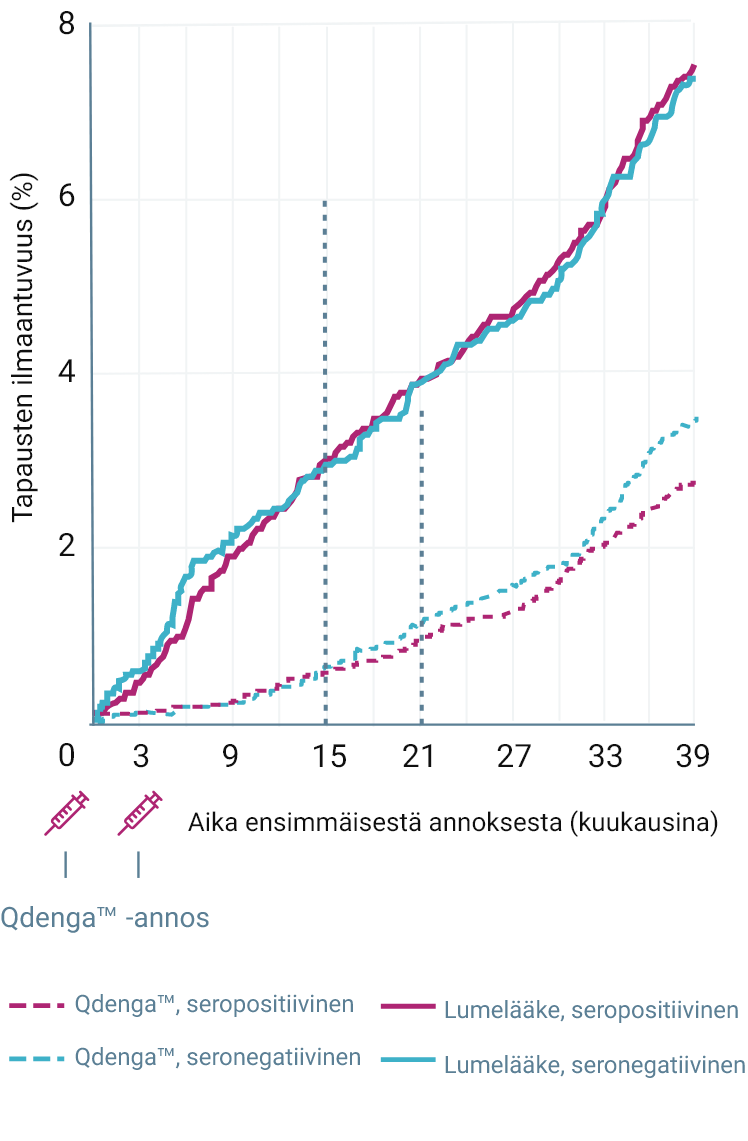
QdengaTM esti tehokkaasti virologisesti vahvistetun denguekuumeen (VCD) suurimmassa osassa tapauksista. 1-4
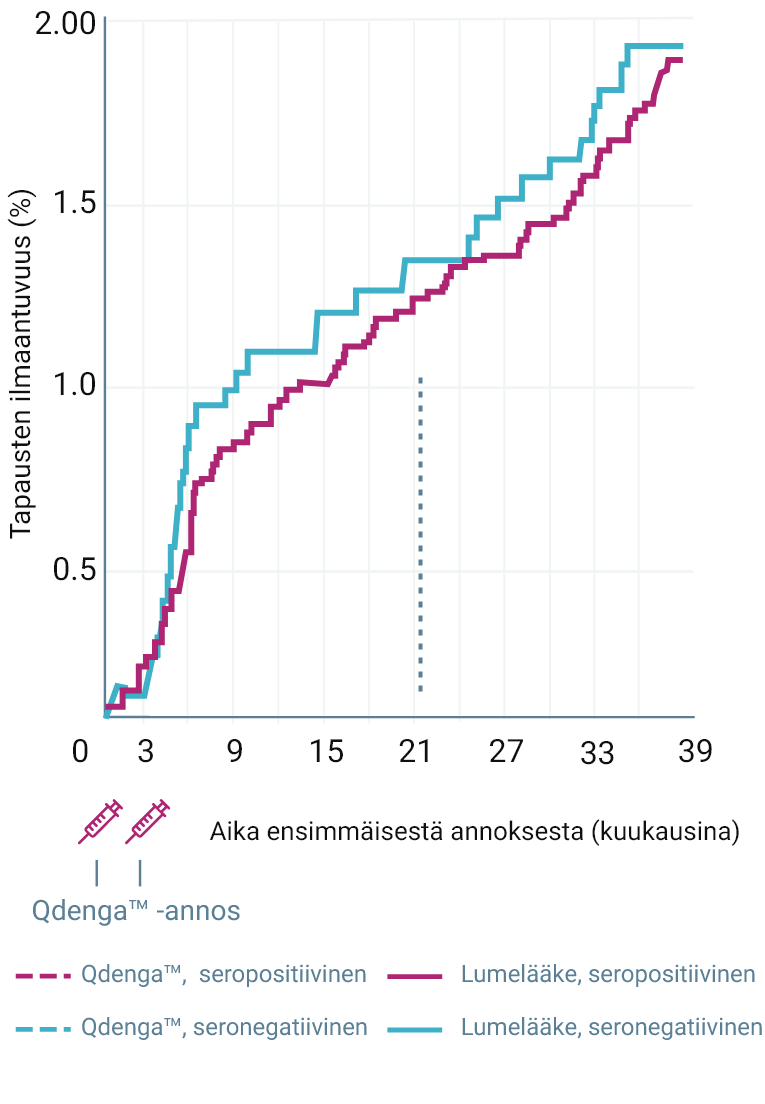
TIDES-tutkimuksen ensisijainen päätetapahtuma saavutettiin: Qdenga™-rokotteella osoitettiin 80,2 %:n kokonaisteho minkä tahansa dengueviruksen serotyypin aiheuttaman, virologisesti vahvistetun denguekuumeen ehkäisyssä 1–12 kuukautta toisen annoksen antamisen jälkeen (95 %:n luottamusväli: 73,3 %–85,3 %, p < 0,001) 1,2
61/12 700 (0,5 %) VCD-tapausta Qdenga™-ryhmässä vs 149/6 316 (2,4 %) tapausta lumeryhmässä 1,2
VCD-TAPAUSTEN KUMULATIIVINEN ILMAANTUVUUS LÄHTÖTILANTEEN SEROSTATUKSEN MUKAAN 2-4
Plus icon
dengue euroopassa|close
Rokotteen yleinen tehokkuus 1 kuukaudesta 12 kuukauteen toisen annoksen jälkeen (95 % CI: 73,3 %–85,3 %, p<0,001) 1,2
61/12 700 VCD-tapausta QdengaTM-ryhmässä vs 149/6316 tapausta lumeryhmässä 1,2
Plus icon
dengue euroopassa|close
Rokotteen yleinen tehokkuus 1 kuukaudesta 18 kuukauteen toisen annoksen jälkeen (95 % CI: 66,5 %–78,8 %) 1,3
114/12 700 denguetapausta QdengaTM-ryhmässä vs 206/6 316 tapausta plaseboryhmässä 1,3
Plus icon
dengue euroopassa|close
Rokotteen yleinen tehokkuus ensimmäisestä annoksesta 54 kuukauden kuluttua toisen annoksen antamisen jälkeen (95 % CI: 56,0 %–65,8 %) 1,4
442/13 380 denguetapausta QdengaTM-ryhmässä vs 547/6 687 tapausta plaseboryhmässä 4
dengue euroopassa|close
Rokotteen yleinen tehokkuus 1 kuukaudesta 12 kuukauteen toisen annoksen jälkeen (95 % CI: 73,3 %–85,3 %, p<0,001) 1,2
61/12,700 VCD cases in the QdengaTM group vs 149/6,316 cases in the placebo group 1,2
Plus icon
dengue euroopassa|close
Rokotteen yleinen tehokkuus 1 kuukaudesta 18 kuukauteen toisen annoksen jälkeen (95 % CI: 66,5 %–78,8 %) 1,3
114/12 700 denguetapausta QdengaTM-ryhmässä vs 206/6 316 tapausta plaseboryhmässä 1,3
Tutkimustarkoituksessa tehty analyysi
dengue euroopassa|close
Rokotteen yleinen tehokkuus ensimmäisestä annoksesta 54 kuukauden kuluttua toisen annoksen antamisen jälkeen (95 % CI: 56,0 %–65,8 %) 1,4
442/13 380 denguetapausta QdengaTM-ryhmässä vs 547/6 687 tapausta plaseboryhmässä 4
Ensisijaista ja toissijaisia päätetapahtumia analysoitiin tutkimussuunnitelman mukaisessa populaatiossa, kumulatiivinen ilmaantuvuus ja eksploratoriset arvioinnit perustuivat turvallisuussarjan tietoihin. 1
VCD = virologisesti vahvistettu denguekuume
* Tapausten ilmaantuvuus: 0,9 % Qdenga™ vs 3,3 % lumelääke 1
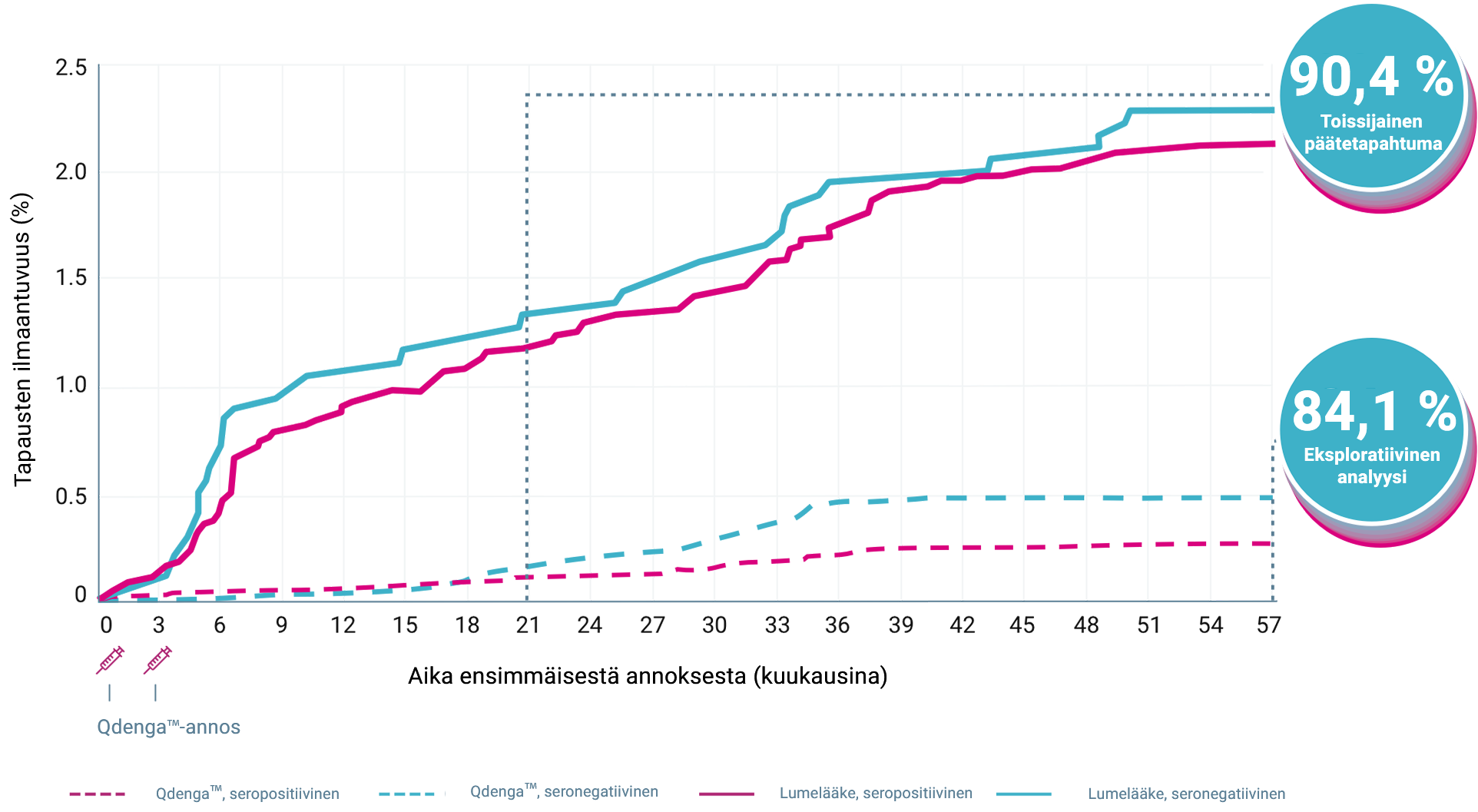
QdengaTM vähensi tehokkaasti virologisesti vahvistetusta denguekuumeesta johtuvaa sairalaahoitoa suurimmassa osassa tapauksista 1-4
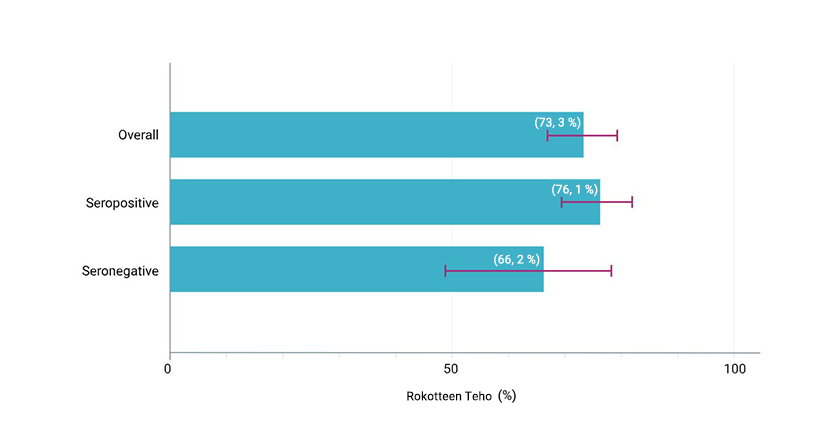
TIDES-tutkimuksen tärkein toissijainen päätetapahtuma saavutettiin: Qdenga™-rokotteella osoitettiin 90,4 %:n kokonaisteho virologisesti vahvistetusta denguekuumeesta johtuvan sairaalahoidon vähentämisessä, kun taudin aiheutti mikä tahansa dengueviruksen serotyyppi 1–18 kuukautta toisen annoksen antamisen jälkeen (95 %:n luottamusväli: 82,6 %–94,7 %, p < 0,001) 1,3
SAIRAALAHOITOA VAATIVIEN VCD-TAPAUSTEN* KUMULATIIVINEN ILMAANTUVUUS LÄHTÖTILANTEEN SEROSTATUKSEN MUKAAN TIDES-TUTKIMUKSESSSA 3,4
Plus icon
dengue euroopassa|close
1–18 kuukautta toisen annoksen antamisen jälkeen (95 % CI: 82,6 %–94,7 %, p<0,001) 1,3
13/12 700 sairaalahoitoa vaativaa tapausta QdengaTM-ryhmässä vs 66/6 316 plaseboryhmässä 1,3
Plus icon
dengue euroopassa|close
Alkaen ensimmäisestä annoksesta ja päättyen 54 kuukautta toisen annoksen jälkeen (95 % CI: 77,8 %–88,6 %) 1,4
46/13 380 denguetapausta QdengaTM-ryhmässä vs 142/6 687 tapausta plaseboryhmässä 4
Plus icon
dengue euroopassa|close
90,4 % (toissijainen tutkittava ominaisuus) 1–18 kuukautta toisen annoksen antamisen jälkeen (95 % CI: 82,6 %–94,7 %, p<0,001 1,3
13/12 700 sairaalahoitoa vaativaa tapausta QdengaTM-ryhmässä vs 66/6 316 plaseboryhmässä 1,3
Uddybende analyse
dengue euroopassa|close
Alkaen ensimmäisestä annoksesta ja päättyen 54 kuukautta toisen annoksen jälkeen (95 % CI: 77,8 %–88,6 %) 1,4
46/13 380 denguetapausta QdengaTM-ryhmässä vs 142/6 687 tapausta plaseboryhmässä 4
* Tutkimussuunnitelmassa ei määritelty tarkkoja sairaalahoidon kriteerejä; henkilöt otettiin sairaalahoitoon yksittäisten tutkijoiden harkinnan mukaan. 3
Ensisijaista ja toissijaisia päätetapahtumia analysoitiin tutkimussuunnitelman mukaisessa populaatiossa; kumulatiivinen ilmaantuvuus ja eksploratiiviset arvioinnit perustuivat turvallisuussarjan tietoihin. 1
90,1 % vähemmän sairaalahoitotapauksia Latinalaisessa Amerikassa (95 %:n luottamusväli 15,3 %–98,8 %) 3
1/6 806 (< 0,1 %) sairaalahoitotapaus QdengaTM-ryhmässä vs 5/3 374 (0,1 %) lumeryhmässä 1–18 kuukautta toisen annoksen jälkeen 3
90,4 % vähemmän sairaalahoitotapauksia Aasiassa ja Tyynenmeren alueella (95 %:n luottamusväli 82,2 %–94,8 %) 3
12/5 893 (< 0,2 %) sairaalahoitotapausta Qdenga™-ryhmässä vs 61/2 942 lumeryhmässä 1–18 kuukautta toisen annoksen antamisen jälkeen 3
QdengaTM-valmisteen teho serostatuksen, dengueviruksen serotyypin ja vaikeusasteen mukaan
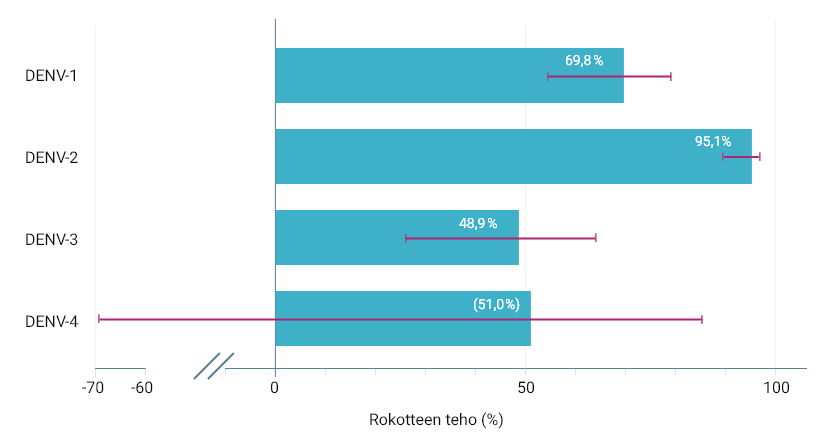
QDENGATM-VALMISTEEN TEHO VCD:N EHKÄISYSSÄ 1–18 KUUKAUTTA TOISEN ANNOKSEN ANTAMISEN JÄLKEEN (TOISSIJAISET PÄÄTETAPAHTUMAT) 3
Close

tutkimustarkoituksessa tehty analyysi
Tutkimusanalyysissa havaittiin 72,0%:n tehokkuus DENV-1:tä vastaan (seropositiivinen, 95% CI: 52,2%–83,6%) ja 67,8% (seronegatiivinen, 95% CI: 40,3%–82,6%), ja 93,7%:n tehokkuus DENV-2:ta vastaan (seropositiivinen, 95% CI: 86,1%–97,1%) ja 98,1% (seronegatiivinen, 95% CI: 85,8%–99,7%); samankaltainen tehokkuus havaittiin vertailukohdan serostatuksesta riippumatta 3
Analyysia DENV-4:n osalta ei voitu suorittaa, koska vain yksi henkilö oli seronegatiivinen vertailukohdassa. Tehokkuus DENV-3:a vastaan vaihteli vertailukohdan serostatuksen mukaan: 61,8% (seropositiivinen, 95% CI: 43,0%–74,4%) ja 68,2% (seronegatiivinen, 95% CI: -318,9%–32,4%); rokotteen tehokkuutta ei osoitettu seronegatiivisissa henkilöissä 3
QDENGANTM TEHOKKUUS SAIRAALAHOITOA VAATINEIDEN TAPAUSTEN VÄHENTÄMISESSÄ 1–18 KUUKAUDEN AJALTA TOISEN ANNOKSEN JÄLKEEN (TOISSIJAISET TUTKITTAVAT OMINAISUUDET) 3
Plus icon
Vakavuus
dengue euroopassa|close
Vakavuus 3
Plus icon
Vakavuus
dengue euroopassa|close
Vakavuus 3
Kahta toissijaista päätetapahtumaa ei saavutettu, pääasiassa tapausten vähäisen määrän takia: 3
- Teho dengueviruksen serotyyppi 4:ää vastaan
- Teho vaikeaa virologisesti vahvistettua denguekuumetta vastaan (Dengue Case Adjudication Committee -komitean kriteerit)
Tämänhetkiset tiedot viittaavat siihen, että rokotteella ei ole tehoa serotyypin DENV-3 aiheuttamaa tartuntaa vastaan lähtötilanteessa seronegatiivisilla henkilöillä, eikä sairauden voimistumisesta ole näyttöä. 1,3
QdengaTM-valmisteen teho yli 17-vuotiailla henkilöillä
QdengaTM-valmisteen kliininen teho 18–60-vuotiailla henkilöillä perustuu immunogeenisuustietojen yhdistämiseen. 1
- QdengaTM-valmisteen immunogeenisuutta 18–60-vuotiailla aikuisilla arvioitiin DEN-304-tutkimuksessa. Tämä vaiheen III kaksoissokkoutettu, satunnaistettu, lumekontrolloitu tutkimus toteutettiin ei-endeemisessä maassa (Yhdysvallat) 1
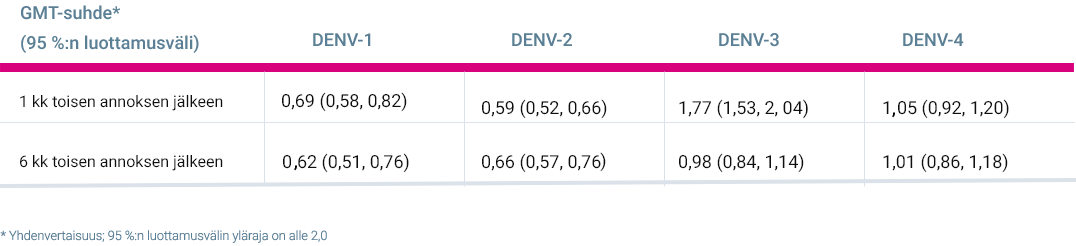
- Tehon tarkastelu perustuu immunogeenisuustietoihin ja tuloksiin yhdenvertaisuusanalyysistä (non-inferiority), jossa tutkitaan lähtötilanteessa dengueseronegattiivisia populaatioita TIDES- ja DEN-304-tutkimuksissa ja verrataan niissä rokottamisen jälkeisiä GMT-arvoja. 1
- Suoja denguetautia vastaan on odotettavissa aikuisilla, vaikka todellinen teho suhteessa lapsilla ja nuorilla havaittuun tehoon ei ole tiedossa. 1
GMT-suhteet lähtötilanteen dengueseronegatiivisten koehenkilöiden välillä TIDES-tutkimuksessa (4–16-vuotiaat) ja DEN-304-tutkimuksessa (18–60-vuotiaat) (tutkimussuunnitelman mukainen analyysi immunogeenisuuden selvittämistä varten) 1

Immunogeenisuus
TIDES-TUTKIMUKSESSA SEROPOSITIIVISUUSTASOT DENGUEKUUMEEN KAIKKIA NELJÄÄ SEROTYYPPIÄ VASTAAN PYSYIVÄT YLI 90 %:SSA JOPA 15 KUUKAUTTA ENSIMMÄISEN QDENGA™-ROKOTTEEN ANTAMISEN JÄLKEEN 3
Seropositiivisuustasot dengueviruksen serotyypin mukaan* 3
Esitetyt seropositiivisuustiedot eivät osoita todeksi kliinistä tehoa eivätkä viittaa suojaan denguekuumetta vastaan.
Arvioitujen osallistujien prosenttiosuus (%)
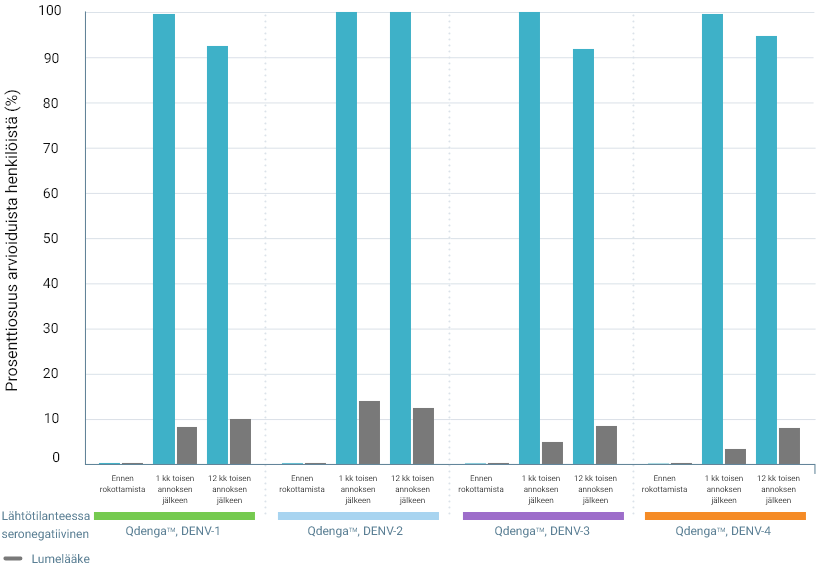
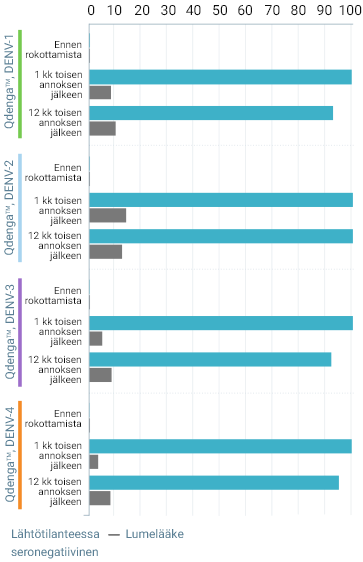
Kuukausi toisen annoksen jälkeen tetravalentin seropositiivisuuden tasot olivat: 3
- 99,5 % lähtötilanteessa seroposiitiivisilla henkilöillä (vs 3,5 % lumelääke)
TIDES-TUTKIMUKSESSA SEROPOSITIIVISUUSLUVUT KAIKKIA NELJÄÄ DENGUESEROTYYPPIÄ VASTAAN PYSYIVÄT YLI 90 %:N TASOLLA ENINTÄÄN 15 KUUKAUTTA ENSIMMÄISEN QDENGATM-ANNOKSEN JÄLKEEN 3
Seropositiivisuusluvut dengueserotyypin mukaan * 3
Esitetty seropositiivisuusdata ei muodosta kliinistä tehokkuutta eikä se merkitse suojausta dengueta vastaan
Arvioitujen osallistujien prosenttiosuus (%)
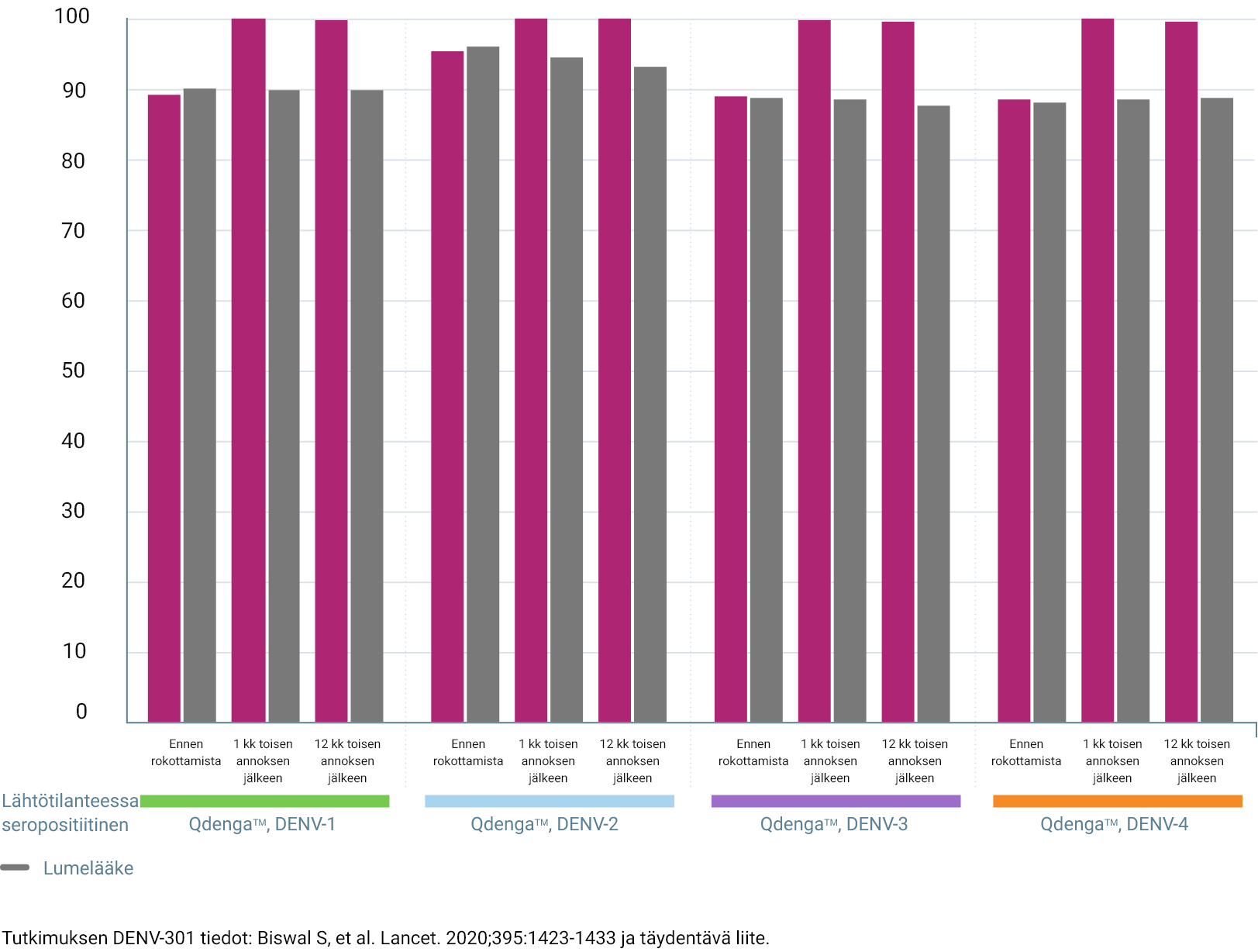
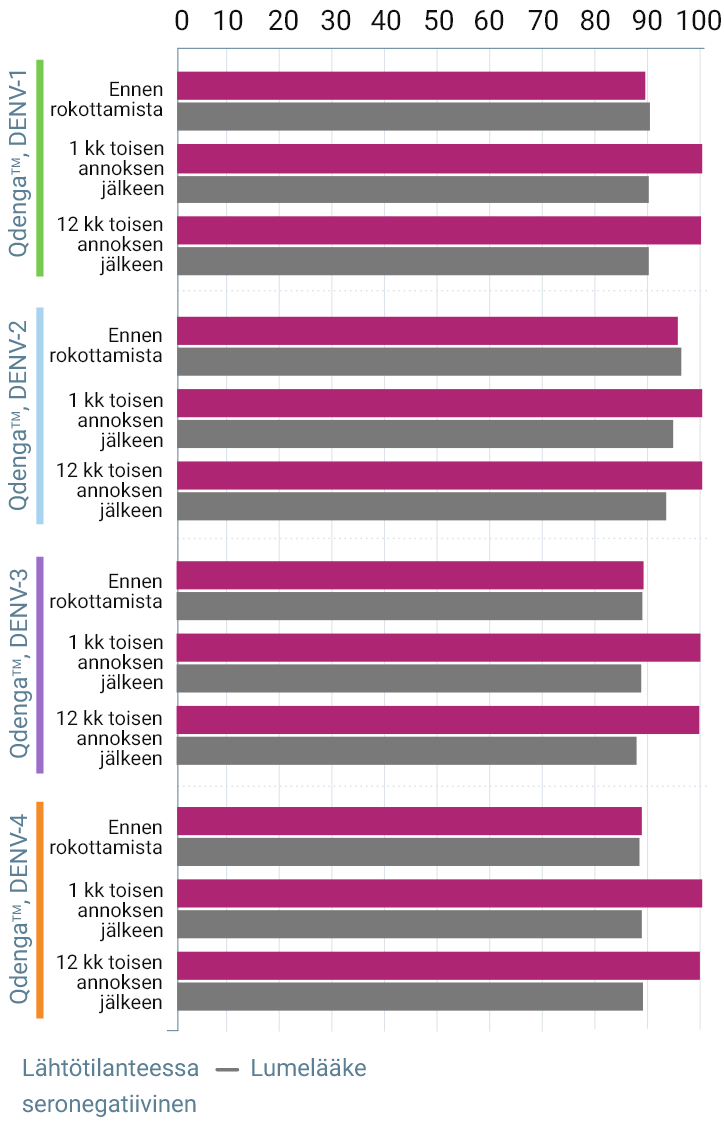
Yhden kuukauden kuluttua toisesta annoksesta kolmivalenttiset seropositiivisuusmäärät olivat: 3
- 99,8 % vertailukohdan seropositiivisissa henkilöissä (vs 85,2 % plasebo)
* Tutkimussuunnitelman mukainen analyysi immunogeenisuustietojen osalta. Seropositiivisen määritelmä: vastavuoroinen neutraloiva vasta-ainetitteri ≥ 10. Lähtötilanteessa seronegatiivisen määritelmä: seronegatiivinen kaikkien serotyyppien suhteen. Lähtötilanteessa seropositiivisen määritelmä: seropositiivinen yhden tai useamman serotyypin suhteen3
Turvallisuusprofiili
TIDES: Turvallisuustiedot
TIDES: Kolmivalenttinen immunisaatio dengueta vastaan, tehokkuustutkimus terveissä lapsissa 2,3
QdengaTM on tähän mennessä ollut hyvin siedetty TIDES-tutkimuksessa 1-4
TIDES-tutkimuksessa:
- Merkittäviä turvallisuusriskejä ei ole havaittu 4,5 vuoden aikana toisen Qdenga™-annoksen antamisen jälkeen 1,4
- Vakavien haittatapahtumien kumulatiivinen ilmaantuvuus oli samanlaista sekä Qdenga™-valmistetta että lumelääkettä saaneilla*. 3
- Enimmillään 18 kuukautta toisen annoksen jälkeen: 4,0 % Qdenga™ vs 4,9 % lumelääke
- Yhdenmukainen tutkimuspopulaatiossa odotettavissa olevien vaivojen kanssa
- Toistaiseksi ei ole näyttöä siitä, että Qdenga™ vaikeuttaisi tautia seronegatiivisilla henkilöillä. 1,3
- Vakavia haittatapahtumia ilmeni 4,3 %:lla sekä seropositiivisista (624/14 520) että seronegatiivisista (238/5 547) henkilöistä enimmillään 18 kuukautta toisen annoksen jälkeen.
Yleiskuva vakavista haittatapahtumista TIDES-tutkimuksen turvallisuustiedoissa* 1–18 kuukautta toisen Qdenga™-annoksen jälkeen 3


Tutkijat, tukijat ja tutkimusta seuraava komitea katsoivat, että mikään kuolemantapaus ei liittynyt Qdenga™-valmisteeseen tai tutkimuksessa tehtyihin toimenpiteisiin: Aseptinen aivokalvotulehdus, aivoverisuonten valtimo-laskimoepämuodostuma, anaplastinen ependymooma, ampumahaava, tukehtuminen ja liikenneonnettomuus 3
Yleiskuva vakavista haittatapahtumista TIDES-tutkimuksen turvallisuustiedoissa* 19–54 kuukautta toisen Qdenga™-annoksen jälkeen 4


* Tutkijan arvion mukaan 3
Qdenga™-valmisteen yleinen kliininen turvallisuus
Qdenga™-valmisteen yleinen turvallisuusprofiili perustuu ositettuun analyysiin, jossa on mukana seronegatiivisia henkilöitä ja joka koostuu 14 627 iältään 4–60-vuotiaasta henkilöstä (13 839 lasta ja 788 aikuista), jotka on rokotettu Qdenga™-valmisteella, sekä 3 830 henkilön reaktogeenisuusalaryhmästä (3 042 lasta ja 788 aikuista). 1
- Yleisimmät haittavaikutukset kliinisissä tutkimuksissa olivat lieviä tai keskivaikeita ja niiden kesto oli lyhyt (1–3 päivää). 1
- Yleisimmin raportoituja haittavaikutuksia 4–60-vuotiailla koehenkilöillä olivat injektiokohdan kipu, päänsärky, lihaskipu, injektiokohdan punoitus, huonovointisuus, heikkous ja kuume. 1
- Haittavaikutuksia esiintyi harvemmin toisen pistoksen jälkeen kuin ensimmäisen pistoksen jälkeen. 1
- Haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste lapsilla olivat yhdenmukaisia aikuisilla havaittujen kanssa. 1
- Qdenga™-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. 1
- Yhdessä kliinisessä tutkimuksessa (DEN-205) havaittiin ohimenevää rokoteviremiaa, johon liittyi lieviä ja keskivaikeita oireita keskimäärin 4 päivän ajan ja jota havaittiin harvoin toisen Qdenga™-annoksen jälkeen. 1
- Valmisteen tuotetiedoista löytyvät täydelliset turvallisuustiedot, varoitukset, käyttöön liittyvät varotoimet ja Qdenga™-valmisteen käytön vasta-aiheet.
Kliinisissä tutkimuksissa raportoidut haittavaikutukset (4–60-vuotiailla) 1
Haittavaikutukset luetellaan seuraavien esiintymistiheyksien mukaisesti: Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000) 1
| Elinjärjestelmäluokka | Esiintymistiheys | Haittavaikutukset | ||||||
|---|---|---|---|---|---|---|---|---|
| Infektiot | Hyvin yleinen |
|
||||||
| Yleinen |
|
|||||||
| Melko harvinainen |
|
|||||||
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen |
|
||||||
| Psyykkiset häiriöt | Hyvin yleinen |
|
||||||
| Hermosto | Hyvin yleinen |
|
||||||
| Melko harvinainen |
|
|||||||
| Ruoansulatuselimistö | Melko harvinainen |
|
||||||
| Iho ja ihonalainen kudos | Melko harvinainen |
|
||||||
| Hyvin harvinainen |
|
|||||||
| Luusto, lihakset ja sidekudos | Hyvin yleinen |
|
||||||
| Melko harvinainen |
|
|||||||
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen |
|
||||||
| Yleinen |
|
|||||||
| Melko harvinainen |
|
a Sisältää ylähengitystieinfektion ja virusperäisen ylähengitystieinfektion
b Sisältää faryngotonsilliitin ja tonsilliitin
c Kerätty alle 6-vuotiailta lapsilta kliinisissä tutkimuksissa
d Sisältää ihottuman, virusihottuman, makulopapulaarisen ihottuman, kutinan
e Raportoitu aikuisilla kliinisissä tutkimuksissa
- [SPC] QdengaTM Summary of Product Characteristics (12/2022).
- [BIS19] Biswal S, et al. N Engl J Med. 2019;381(21):2009-2019 and supplementary appendix.
- [BIS20] Biswal S, et al. Lancet. 2020;395:1423-1433 and supplementary appendix.
- [TRI22] Tricou V, et al. Efficacy and Safety of Takeda’s Tetravalent Dengue Vaccine Candidate (TAK-003) After 4.5 Years of Follow-Up. Presented at: 44th ICMM World Congress on Military Medicine, 5–9 September 2022; Brussels, Belgium.
- [CT1] Takeda. Lot-to-lot consistency of 3 lots of tetravalent dengue vaccine (TDV) in non-endemic country(ies) for dengue. ClinicalTrials.gov Identifier: NCT03423173. Updated October 20, 2020. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/study/NCT03423173 - [CT2] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) at the end of shelf life in healthy adults. ClinicalTrials.gov Identifier: NCT03771963. Updated June 7, 2021. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03771963 - [CT3] Takeda. Immunogenicity and safety of dengue tetravalent vaccine (TDV) and recombinant 9-valent human papillomavirus vaccine (9vHPV) in participants aged ≥9 to <15 years. ClinicalTrials.gov Identifier: NCT04313244. Updated July 25, 2022. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT04313244 - [CT4] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) co-administered with an hepatitis A virus vaccine. ClinicalTrials.gov Identifier: NCT03525119. Updated August 19, 2022. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03525119 - [CT5] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) in adolescents in non-endemic area(s). ClinicalTrials.gov Identifier: NCT03341637. Updated August 15, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03341637 - [CT6] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) administered with a yellow fever vaccine in adults. ClinicalTrials.gov Identifier: NCT03342898. Updated October 8, 2020. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03342898 - [CT7] Takeda. Safety and immunogenicity of Takeda's tetravalent dengue vaccine (TDV) in healthy children. ClinicalTrials.gov Identifier: NCT02948829. Updated July 25, 2022. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT02948829 - [CT8] Takeda. Efficacy, Safety and Immunogenicity of Takeda's Tetravalent Dengue Vaccine (TDV) in Healthy Children (TIDES). ClinicalTrials.gov Identifier: NCT02747927. Updated August 1, 2022. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT02747927 - [CT9] Takeda. Safety and immunogenicity with two different serotype 2 potencies of Takeda's tetravalent dengue vaccine candidate (TDV) in adults in Singapore. ClinicalTrials.gov Identifier: NCT02425098. Updated August 28, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT02425098 - [CT10] Takeda. Immunogenicity and safety of tetravalent dengue vaccine candidate (TDV) in flavivirus-naïve and dengue-immune adults. ClinicalTrials.gov Identifier: NCT03746015. Updated February 25, 2022. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03746015 - [CT11] . Takeda. Safety and immunogenicity of different schedules of Takeda's tetravalent dengue vaccine candidate (TDV) in healthy participants. ClinicalTrials.gov Identifier: NCT02302066. Updated February 24, 2020. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT02302066 - [CT12] Takeda. Long-term safety and antibody persistence of TDV and the impact of a booster dose. ClinicalTrials.gov Identifier: NCT03999996. Updated November 17, 2021. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT03999996 - [CT13] Takeda. Study to investigate the safety and immunogenicity of a tetravalent chimeric dengue vaccine in healthy volunteers between the ages of 1.5 - 45 years. ClinicalTrials.gov Identifier: NCT01511250. Updated July 18, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT01511250 - [CT14] Takeda. Safety and immunogenicity of three formulations of Takeda's tetravalent dengue vaccine candidate (TDV). ClinicalTrials.gov Identifier: NCT02193087. Updated July 18, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT02193087 - [CT15] Takeda. Impact of SC vs IM administration of DENVax (TDV) on safety and immunogenicity. ClinicalTrials.gov Identifier: NCT01728792. Updated July 18, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT01728792 - [CT16] Takeda. A comparison of the safety and immunogenicity of various schedules of dengue vaccine in healthy adult volunteers. ClinicalTrials.gov Identifier: NCT01542632. Updated July 18, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT01542632 - [CT17] Takeda. Phase 1b study investigating safety & immunogenicity of TDV given intradermally by needle or needle-free PharmaJet Injector. ClinicalTrials.gov Identifier: NCT01765426. Updated July 18, 2019. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT01765426 - [CT18] Takeda. Safety and immunogenicity study to assess TDV, a live attenuated tetravalent vaccine for prevention of dengue fever. ClinicalTrials.gov Identifier: NCT01224639. Updated June 19, 2018. Accessed October 12, 2022.
https://clinicaltrials.gov/ct2/show/NCT01224639

